
Science with Passion
App-Nr.: VBS0086
Version 1 05/2025
Schnelle Proteinanalyse von Mucinen mit einem AZURA® SEC-System
J. Wesolowski1, J.L. Dauwe2, C. Dauwe2, J. Kramer1, K. Folmert1, G. Greco1;
wesolowski@knauer.net
1 KNAUER Wissenschaftliche Geräte GmbH, Hegauer Weg 38, 14163 Berlin

2 AppliChrom GmbH®, Germendorfer Allee 20, 16515 Oranienburg bei Berlin,
https://www.applichrom.de

Zusammenfassung
Das KNAUER AZURA® SEC-System ist bekannt als ein robustes Gelpermeationschromatographie (GPC) oder Größenausschlusschromatographie (SEC) System für fortgeschrittene Anwendungen sowie Hochdurchsatzanalysen. In Kombination mit einer AppliChrom® VivoSep-Säule demonstrieren wir die Leistung des KNAUER AZURA® SEC-Systems für die Analyse von kommerziell erhältlichem bovinem Submaxillarmucin und porcinem Magenschleim. Das Material der VivoSep SEC-Säule verwendet ein mehrstufiges, hydrophil modifiziertes polymerbasiertes Design, das hochauflösende Analysen von Proteinen über einen breiten Molekulargewichtsbereich ermöglicht.
Einführung
Mucine sind Glykoproteine, die durch eine Kombination aus Proteinen und Kohlenhydraten gekennzeichnet sind1.
Sie spielen eine wichtige Rolle in biologischen Prozessen, insbesondere beim Schutz der Schleimhäute vor mechanischen, chemischen und biologischen Einflüssen2. Aufgrund ihres hohen Gehalts an Zuckermolekülen haben Mucine eine starke hydrophile Tendenz, die ihnen hilft, Wasser zu binden und eine gelartige Konsistenz zu bilden3,4,5. Sie sind Teil einer Mischung aus Wasser, Salzen, Lipiden, Zellmaterial und anderen Proteinen, die den Schleim bilden, der die Oberflächen der Schleimhäute von Organismen wie Mund und Nase bedeckt1,2. Dabei sind die Mucine entscheidend für die physikalischen Eigenschaften des Schleims, insbesondere für seine Viskosität1.
Ein wichtiges analytisches Werkzeug zur Charakterisierung von Mucinen ist SEC1. Diese Methode ermöglicht die Bestimmung des Molekulargewichts und der Molekulargewichtsverteilung von Mucinen, was zu einem besseren Verständnis ihrer biologischen Funktionen beiträgt1. Darüber hinaus ermöglicht SEC eine effiziente Isolation von Mucinen aus Bioflüssigkeiten, was zu gereinigten Mucinfraktionen führt, die für weitere Analysen oder medizinische Anwendungen, wie Biomarker in der Krebsdiagnose und -prognose, verwendet werden können6,7. Insgesamt ist SEC eine sanfte chromatographische Technik, die unter milden Bedingungen wie Raumtemperatur und neutralem pH8 durchgeführt wird. Dies stellt sicher, dass die native Konformation und Funktion der Mucine während des Trennprozesses erhalten bleibt, was entscheidend für die Erhaltung ihrer biologischen Aktivität und Interaktionen ist8.
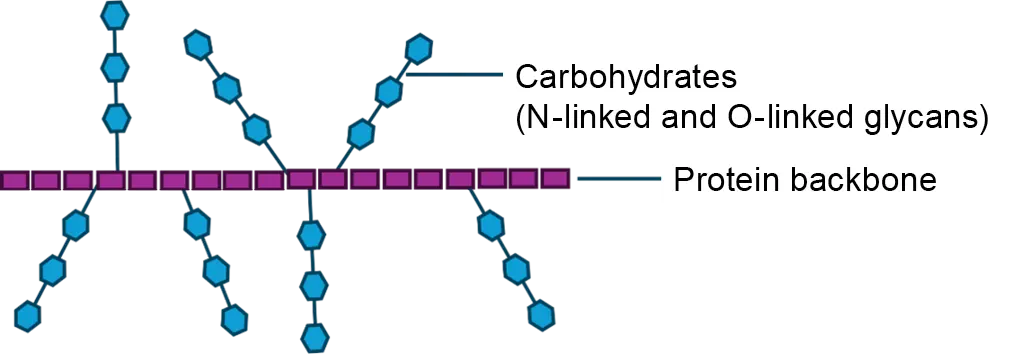
Abb. 1 Modell der Glykoproteinstruktur von Mucinen.
Probenvorbereitung
Für die Analyse wurden kommerziell erhältliche bovine submaxilläre Mucin- und porcine Magenschleimproben verwendet.
Ergebnisse
Die am häufigsten verwendeten Materialien in der SEC sind vernetztes Dextran oder Agarose (Sephadex/Sepharose), Polyacrylamidperlen (Bio-Gel) und Dextran-Derivate (Sephacryl)9. AppliChrom® hat die VivoSep SEC-Serie entwickelt, die hochauflösende Trennungen von Proteinen ermöglicht. Diese spezielle mehrstufige, hydrophile, modifizierte Polymer-basierte SEC-Säule bietet erheblich erweiterte Möglichkeiten zur Analyse größerer Proteine, indem sie einen Molekulargewichtsbereich von 100 Da bis 5 000 000 Da abdeckt. Hier zeigen wir, dass dieses Säulenmaterial in Verbindung mit dem KNAUER AZURA® SEC-System für einfache Messungen von und porzinen Magenmucin (Abb. 2) und bovinem Submaxillarmucin (Abb. 3) geeignet ist. Die gezeigten Daten für dieses Anwendungsnotiz wurden von AppliChrom® bereitgestellt.
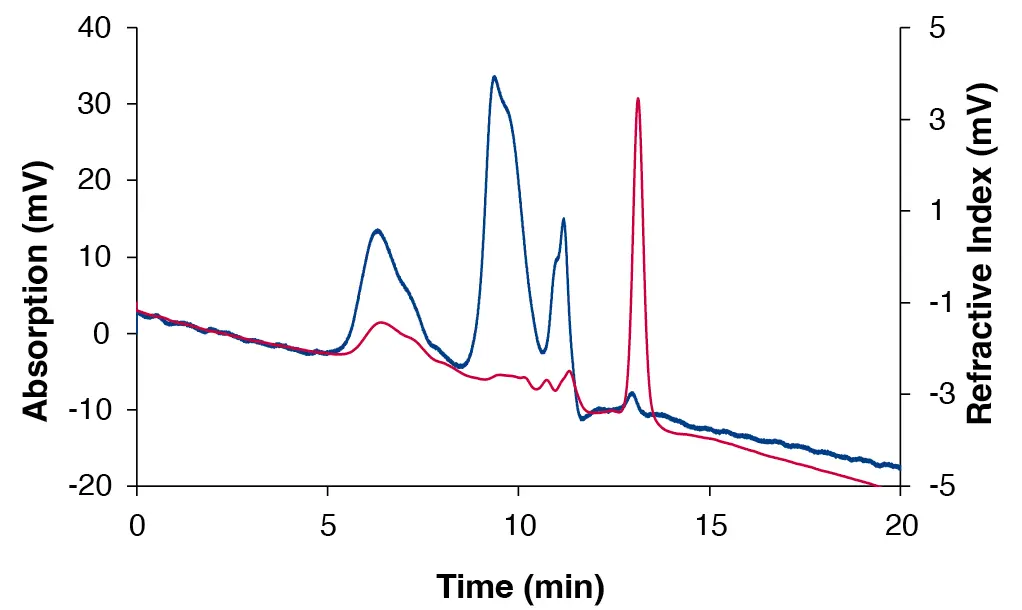
Abb. 2 Chromatogramm des porzinen Magenmucins, gemessen mit dem VivoSep SEC 350 (Trennbereich 2 500 - 1 000 000 Da), DAD bei 220 nm (blau) und RID (rot).
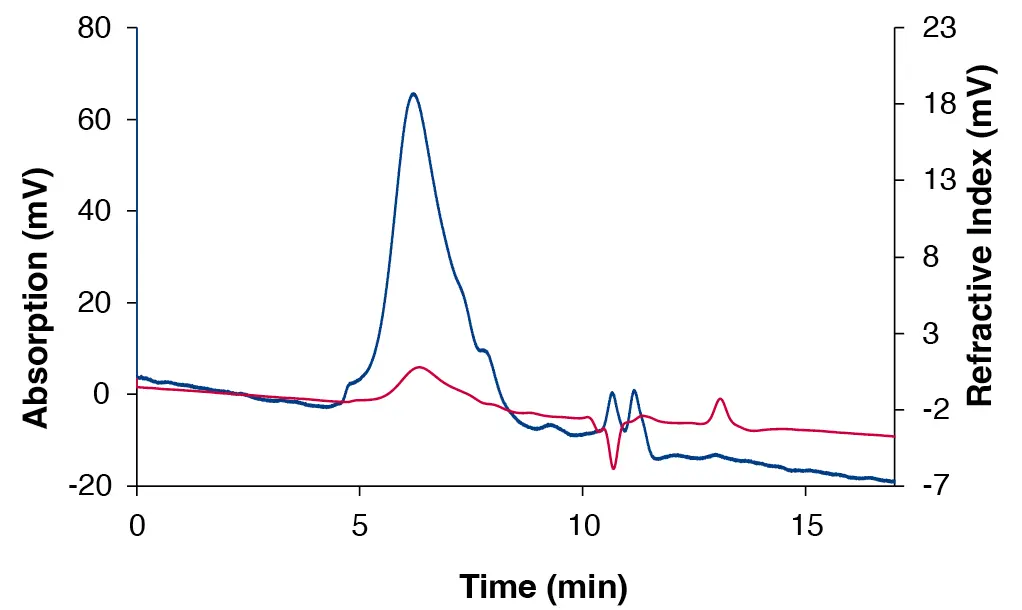
Abb. 3 Chromatogramm des bovinen submaxillären Mucins, gemessen mit dem VivoSep SEC 350 (Trennbereich 2 500 - 1 000 000 Da), DAD bei 220 nm (blau) und RID (rot).
Es wurde gezeigt, dass Mucine in 15 Minuten analysiert werden können (Abb. 2 und Abb. 3). Im Gegensatz dazu erfordert die Analyse mit gängigen Säulen, die mit quervernetztem Dextran oder agarosebasierten Harzen arbeiten, bis zu 300 Minuten. Darüber hinaus haben AppliChrom® VivoSep SEC-Säulen eine hervorragende Druckstabilität von 50 bis 200 bar, abhängig von der Porengröße. Im Vergleich dazu sind quervernetzte Dextran-SEC-Säulen nur bei Drücken von 5 bar oder weniger stabil. Diese hohe Druckstabilität ermöglicht auch die Verwendung kleinerer Partikel (7 - 10 µm),
Fazit
Das KNAUER AZURA® SEC-System in Kombination mit der AppliChrom® VivoSep SEC-Säule bietet erhebliche Zeitersparnisse bei der Analyse von Mucinen. Diese Lösung bietet eine gute Trennleistung und ist eine innovative Ergänzung im Bereich der Größenausschlusschromatographie von Proteinen.
Material und Methoden
Tab. 1 Methodenparameter.
Parameter | Wert |
Durchflussrate | 1 ml/min |
Isokratisk | H2O / PBS-Puffer |
Kolonnentemperatur | 25 °C |
Injektionsvolumen | 8 µl |
Injektionsmodus | Teilweise Schleife |
Erkennung 1 | DAD 220 nm |
Erkennung 2 | RID |
Datenrate | 10 Hz |
Zeitkonstante | 0.1 s |
Zeit | 20 min |
Tab. 2 Systemkonfiguration.
Instrument | Beschreibung | Artikel-Nr. |
Pumpe | AZURA® P 6.1L LPG-Pumpe mit 10 ml Pumpenkopf, Edelstahl | |
Autosampler | AZURA® AS 6.1L, analytischer HPLC-Autosampler, 862 bar | |
Detektor 1 | AZURA® DAD 2.1L, 190 - 700 nm | |
Detektor 2 | AZURA® RID 2.1L, analytischer Brechungsindexdetektor | |
Thermostat | AZURA® CT 2.1 | |
Eluentenbehälter | AZURA® E 2.1L | |
Spalte | AppliChrom® VivoSep SEC 350, 10 µm, | |
Kapillaren | Start-Up-Kit mit flexiblen, vorgeschnittenen Kapillaren für analytische HPLC-Systeme mit 1/16"-Anschlüssen | |
Software | ClarityChrom® 9.1.0 - Workstation, Steuerung des Autostichprobennehmers enthalten | |
Software | ClarityChrom® 9.1.0 - SEC/GPC Erweiterung |

Fig. 4 SEC System Setup.
Referenzen
[1] Jumel, K., Fiebrig, I. & Harding, S. E. (1996). Schnelle Größenverteilung und Reinheitsanalyse von Mucus-Glykoproteinen des Magens durch Größenausschlusschromatographie/multi- Winkel-Laserlichtstreuung. Internationale Zeitschrift für biologische Makromoleküle, 18 (1-2), 133-139.
[2] Schoemig, V., Isik, E., Martin, L. & Berensmeier, S. (2017). Fest-Flüssig-Flüssig-Extraktion von porzinen Mucinen aus homogenisiertem Tiermaterial. RSC Advances, 7 (63), 39708-39717.
[3] Johansson, M. E. V., Larsson, J. M. H. & Hansson, G. C. (2010). Die beiden Schleimschichten des Kolons werden durch das MUC2-Mucin organisiert, während die äußere Schicht als Regulator der Wirt-Mikroben-Interaktionen fungiert. Proceedings Of The National Academy Of Sciences, 108 (supplement_1), 4659-4665.
[4] Crouzier, T., Boettcher, K., Geonnotti, A. R., Kavanaugh, N. L., Hirsch, J. B., Ribbeck, K. & Lieleg, O. (2015). Modulation der Mucin-Hydration und -Schmierung durch Deglykosylierung und Polyethylenglykol-Bindung. Advanced Materials Interfaces, 2 (18).
[5] Schömig, V. J., Käsdorf, B. T., Scholz, C., Bidmon, K., Lieleg, O. & Berensmeier, S. (2016). Ein optimierter Reinigungsprozess für porcine Magenmucin mit Erhaltung seiner nativen funktionalen Eigenschaften. RSC Advances, 6 (50), 44932-44943.
[6] Schuster-Little, N., Sokolovsky, A. D., Gentry, A., Saraf, A., Etzel, M. R., Patankar, M. S. & Whelan, R. J. (2024). Immunoaffinitätsfreie chromatographische Reinigung des Ovarialkrebs-Biomarkers CA125 (MUC16) aus Blutserum ermöglicht die Charakterisierung mittels Massenspektrometrie. Analytische Methoden, 16 (37), 6337-6348.
[7] Felder, M., Kapur, A., Gonzalez-Bosquet, J., Horibata, S., Heintz, J., Albrecht, R., Fass, L., Kaur, J., Hu, K., Shojaei, H., Whelan, R. J. & Patankar, M. S. (2014). MUC16 (CA125): Tumormarker für die Krebstherapie, ein Arbeitsfortschritt. Molekulare Krebsforschung, 13 (1).
[8] Hall, M. (2018). Größenausschlusschromatographie (SEC). Biopharmazeutische Verarbeitung, 421-432.
[9] Hostettmann, K., Marston, A. & Hostettmann, M. (1998). Trennung von Makromolekülen. Präparative Chromatographietechniken (202-216).
[10] Sandberg, T., Blom, H. & Caldwell, K. D. (2008). Potenzielle Verwendung von Mucinen als Beschichtungen für Biomaterialien. I. Fraktionierung, Charakterisierung und Modelladsorption von bovinen, porcine und humanen Mucinen. Journal Of Biomedical Materials Research Part A, 91A (3), 762-772.
Anwendungsdetails
|
Methoden |
GPC/SEC |
|
Modus |
GPC/SEC |
|
Substanzen |
Bovines Submaxillarmucin, porzines Magenschleim |
|
CAS-Nummer |
84082-64-4, 84195-52-8 |
|
Version |
App-Nr.: VBS0086 | Version 1 |


